Содержание
- Количество электронов в валентной оболочке
- Шаг 1
- Шаг 2
- Шаг 3
- Шаг 4
- Структура Льюиса
- Шаг 1
- Шаг 2
- Шаг 3
- Формальный заряд каждого атома
- Шаг 1
- Шаг 2
- Шаг 3
При определении формального заряда молекулы, такой как CoCl2 (газ фосген), необходимо знать количество электронов в валентном слое каждого атома и структуру Льюиса молекулы.
Количество электронов в валентной оболочке
Шаг 1
Найдите каждый атом в периодической таблице элементов, чтобы определить количество электронов в валентной оболочке.
Шаг 2
Помните, что два электрона находятся на первом подуровне s, два - на втором подуровне s, шесть электронов - на первом подуровне p и т. Д. Помните: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
Шаг 3
Ударь по нагрузке. Если молекула представляет собой ион, добавьте или вычтите один или несколько электронов из общего количества, чтобы получить окончательный заряд.
Шаг 4
Для CoCl2 (газообразный фосген): C = 4; О = 6; Cl = 7. Молекула не ионизируется и имеет нейтральный заряд. Следовательно, общее количество электронов в валентной оболочке составляет 4 + 6 + (7x2) = 24.
Структура Льюиса
Шаг 1
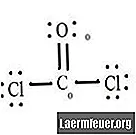
См. Диаграмму структуры Льюиса CoCl2 (газ фосген). Структура Льюиса представляет собой наиболее стабильную и вероятную структуру для молекулы. Атомы притягиваются парными валентными электронами; связи образуются между свободными электронами, чтобы удовлетворить правилу октетов.
Шаг 2

Нарисуйте каждый атом и его валентные электроны, а затем при необходимости сформируйте связи.
Шаг 3
Атомы хлорида имеют простые связи с молекулой углерода, а атом кислорода образует двойную связь с углеродом. Каждый атом в окончательной структуре удовлетворяет правилу октетов и имеет восемь электронов в валентной оболочке, что обеспечивает стабильность молекулы.
Формальный заряд каждого атома
Шаг 1
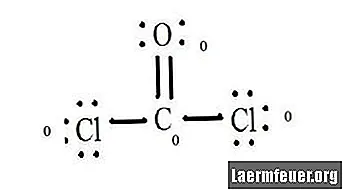
Подсчитайте безэлектронные пары каждого атома в структуре Льюиса. Каждому атому присваивается электрон от каждой связи, в которой он участвует. Сложите эти числа. В CoCl2: C = 0 свободных пар плюс 4 электрона связи = 4 электрона. O = 4 электрона свободных пар плюс 2 электрона связей = 6 электронов. Cl = 6 электронов свободных пар плюс один электрон связи с C = 7 электронов.
Шаг 2
Вычтите количество электронов в валентной оболочке несвязанного атома. Результат - формальный заряд для каждого атома. В CoCl2: C = 4 валентных электрона (эв) в несвязанном атоме минус 4 электрона, обозначенных в структуре Льюиса (LS) = 0 формальный заряд O = 6 эв - 6 LS = 0 формальный заряд Cl = 7 эв - 7 LS = 0 формальных грузов
Шаг 3
При записи поместите эти заряды рядом с атомами в структуре Льюиса. Если у молекулы есть заряд в целом, поместите структуру Льюиса в скобки так, чтобы заряд был написан снаружи в правом верхнем углу.